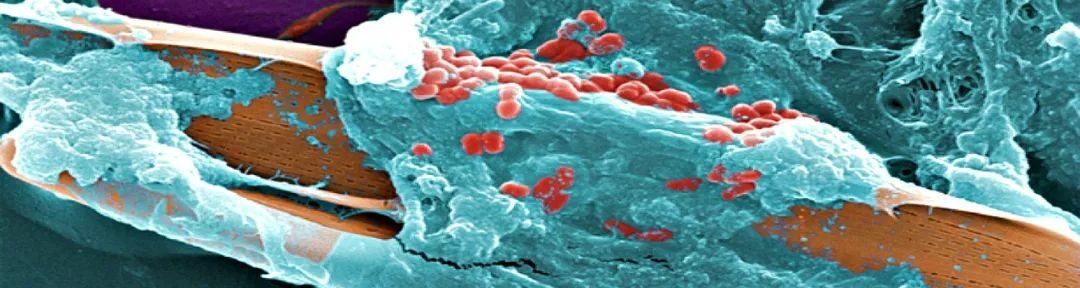
介绍:微生物生物膜(Microbial biofilm)
尽管微生物研究的重点是浮游细菌(单个微生物、自由悬浮细菌),人们越来越认识到细菌在自然界和临床中主要以生物膜形式存在【1】。过去几十年的研究发现自然界中所有已知微生物的99.9%均附着于表面,这主要是因为附着群落所能提供的营养和保护特性【2】。一旦细菌附着于表面,他们便产生复杂的胞外聚合物(含有多聚糖、蛋白质和核糖核酸)【3-5】,不仅能帮助菌落增加附着力,而且能使得细菌之间保持密切联系。随着特定区域细菌数量的增加,附着菌落即形成生物膜。
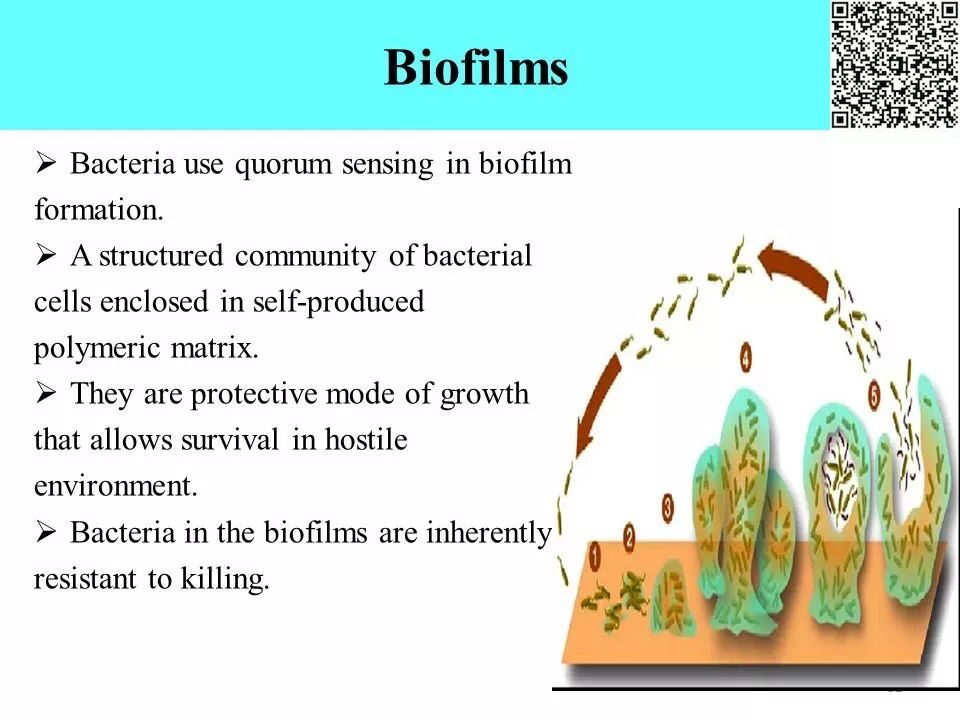
生物膜的主要特点
形成中借助于群体感应;包裹于自我产生的胞外聚合物中的结构化细菌社群;极强的自我保护能力
生物膜的形成
生物膜是微生物的三维嵌合联合体,在物体表面积聚,被细胞外聚合物或糖衣包被,结构中散布水道【6,7】。生物膜大部分(80-85%)为胞外聚合物,剩余15-20%则是微生物【2】。生物膜的高含水量使其观察变得困难,因为脱水时胞外聚合物会向细菌表面塌陷。细菌生物膜的形成开始于浮游细菌通过布朗运动或鞭毛运动向暴露、覆膜表面的靠近。其克服了细胞表面与接触面之间的静电排斥力,完成初始附着【8】。根据所处环境的不同,会形成不同类型的生物膜【9】。一旦完成附着,由初始定植微生物构成的微集落便会快速发展【10】。此时,细菌被保护性基质包埋,开始表现出生物膜的表型(图1),包括变得更加耐受抗菌治疗和宿主免疫。新生微集落中的细菌细胞释放群体效应分子(小分子量分子),浓度随着菌落体积的增加而增加。进而,群体效应分子激发特定基因的表达,帮助细菌集落形成成熟的生物膜。一旦生物膜在表面确立和成熟,即开始释放游离菌,这些游离细菌会寻找新的适宜地点定植发展。
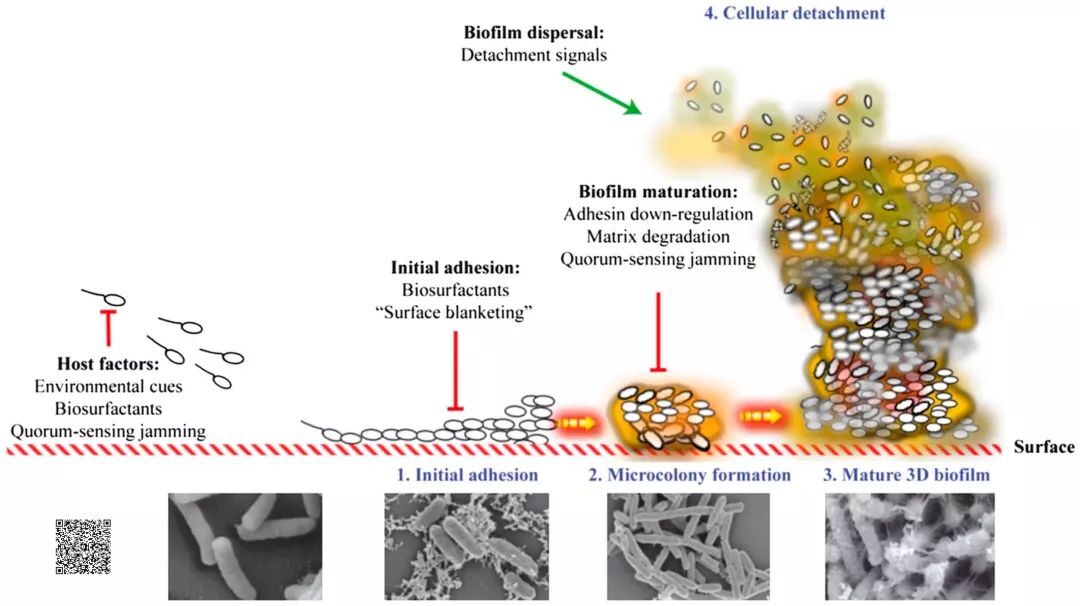
图1: 生物膜形成过程,包括使用电子扫描显微镜观察到的每个阶段。
群体感应(Quorum sensing)
群体感应是生物膜形成和生物膜特异性特性表达中的关键过程。群体感应分子,被称为自体诱导分子(Autoinducers, AIs),已经在很多不同种类的细菌中被发现,很多不同的分子在群体感应中发挥作用。已经被发现的AIs有很多。被研究最多的是由革兰氏阴性细菌产生N-酰基高丝氨酸内酯(AHLs)【13】。此外,革兰氏阳性菌通常能产生小分子肽和一类被称为AI-2的分子,其结构大多不为人知【14,15】。无论是哪种类型的分子参与,这些小分子的AIs在细菌细胞中以基础速率生产。一些AIs能够自由穿越细菌胞膜,此时,细胞内的浓度与胞外环境中类似。随着局部微集落细菌数量的不断增加,AI的有效浓度升高。一旦细胞内AI的浓度达到阈值水平,AIs便能诱发基因表达的一些变化。其中即有生物膜特有的特性。AI分子对生物膜形态的影响将会在后续内容讨论。有趣的是,针对群体感应人们研究最多的两种细菌,金黄色葡萄球菌和绿脓杆菌,也是最常与慢性伤口相关联的菌种。金葡菌,与其他革兰氏阳性菌一样,使用以寡肽为基础的群体感应系统【16】;其群体感应由agr位点编码的自诱导肽(AIPs)介导。这一位点也控制一些毒性因素,包括生物膜形成【17,18】。同样,绿脓杆菌的群体感应系统也被广泛研究。其很多毒性因素被发现是由群体感应系统控制,包括分泌毒性因子(如蛋白酶)、细胞黏附因子(如脂多糖)、和生物膜形成【19】。群体感应在生物膜形成的早期阶段发挥作用,群体感应变异后即不能形成结构正常的生物膜【20】。

关于群体感应的作用
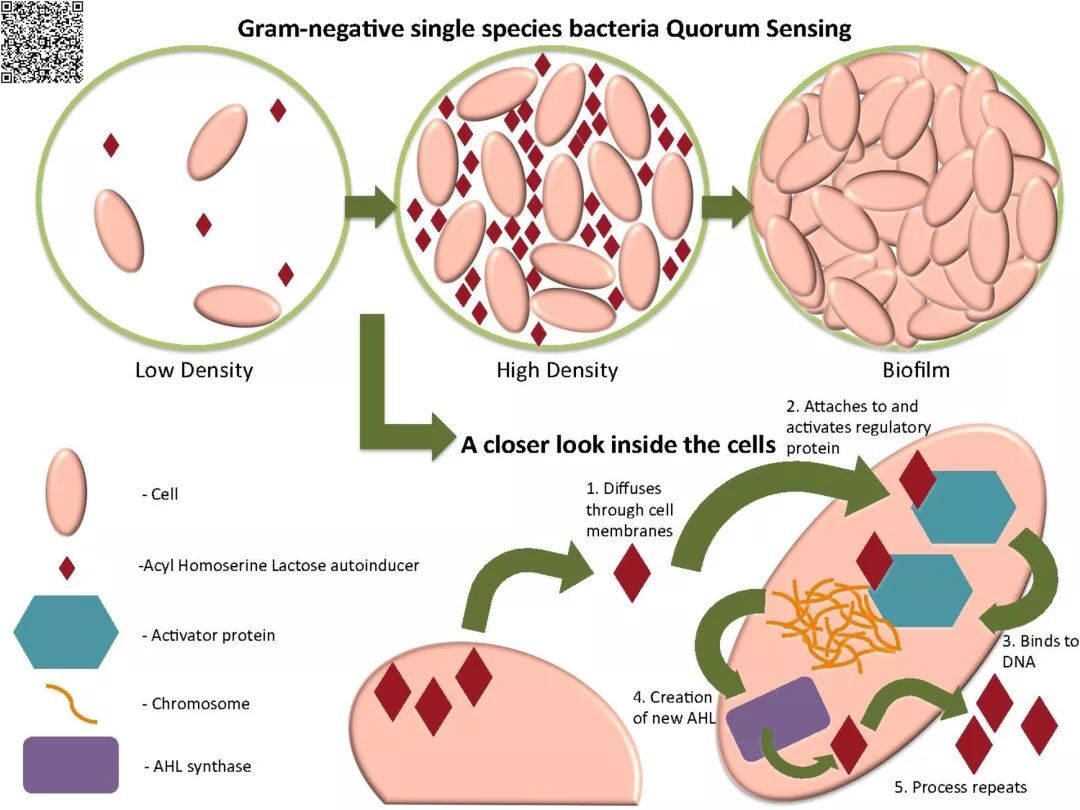
革兰氏阴性菌的群体感应过程
生物膜耐药(Biofilm resistance)
体内/外证据表明胞外聚合物能保护慢性伤口生物膜免受对伤口愈合至关重要的炎症反应的影响【32】。胞外聚合物被认为可以阻断补体激活【33】、抑制淋巴增殖反应【34】、和防止吞噬细胞对细菌细胞壁调理素的识别。研究还显示胞外聚合物能限制淋巴细胞穿透生物膜的能力【32】、阻碍其穿行生物膜的移动、减弱其脱粒和生产活性氧的能力、和防止细菌被吞噬【31,35】。将细菌暴露于低抑制抗菌剂浓度、或错误的抗生素,可能会诱导出类粘蛋白表型,产生含有更多基质成份的更厚的生物膜【36,37,38】。
关于生物膜对激进治疗方法耐受的机制有很多,包括:
· 生物膜集落的生理异质性【45】
· 持留菌(persister cells)的存在使得生物膜在治疗后得以再增殖【46,47,48】
· 生物膜内细菌的低代谢率影响常用抗生素的作用机制【2,48,49】
· 外排泵开放读码框的过度表达【50】
· 胞外聚合物对药物弥散的限制【29】
· 耐药基因优势,在生物膜中微生物间可轻松转移【51】
生物膜结构和形态学
生物膜最早被认为是微生物的无序积聚。不同环境中形成的生物膜结构类似之前是支持这一观点的证据。后来发现的证据显示基因(细胞信号和胞外聚合物物质的差异)和环境因素(营养和液体流)均影响生物膜的结构和形态【52,53】。随着纳米线和蜂巢的发现,目前有确定证据显示生物膜的结构和形态比人们早先认为的要更加有序。
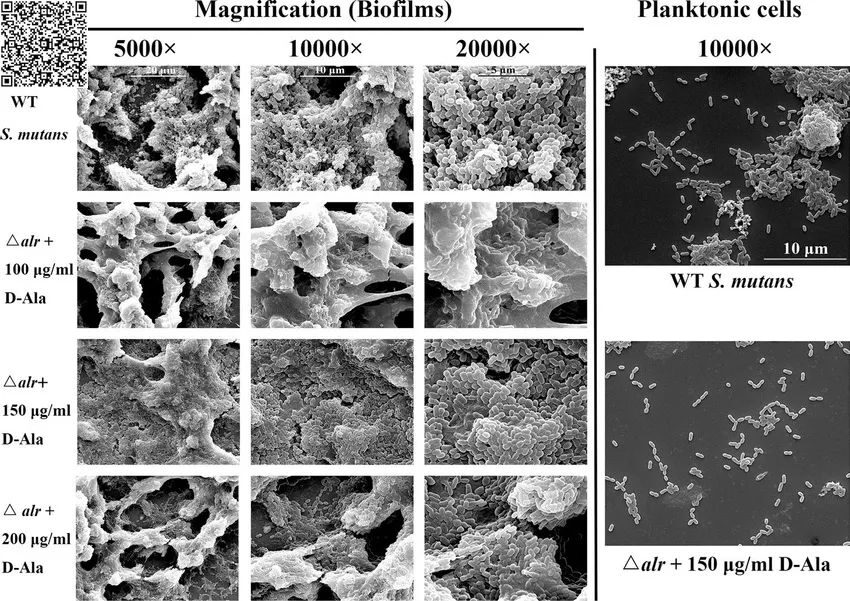
生物膜 vs 游离细菌
研究证明绿脓杆菌集落的几何结构经过了优化以获得生长效率【55,56】。通过集落形态分析和数学模型,研究发现绿脓杆菌形成高脊或皱褶(也被称为集落粗糙度)以增加与氧气的接触来应对细胞氧化还原反应减弱的状态【55,56】。这些皱褶会根据周围环境的氧气浓度到达一个固定的宽度,但会继续长高,表明是电子受体而不是营养供给限制了其特点的发展。内源性氧化还原抗生素(phenazine-吩嗪)的产生会形成低的表面积(如更宽/更少皱褶)【55】。这是因为吩嗪作为生物膜缺氧区域的电子受体,会将电子转移至充气良好的区域,使得细胞得以平衡其内部氧化还原状态【55-59】。吩嗪似乎不能影响绿脓杆菌的附着,但会影响群体移动(可能是通过调节鞭毛功能)和生物膜表面剂-体积比率;不同的吩嗪对于集落结构有不同影响,而吩嗪对于不同细菌种类有不同影响【60】。外源性硝酸盐(一种被绿脓杆菌使用的替代电子受体)对生物膜形态的影响与吩嗪类似。氧气含量和/或替代电子受体也会影响生物膜基地深度和整个集落表面剂。其他影响生物膜结构的细胞行为包括趋化性(Chemotaxis)、细胞外基质(ECM)生产、化学信号传导等【55,61-63】。呼吸受损,包括低铁水平导致的呼吸器内细胞色素合成缺陷,被发现可作为激发枯草杆菌基质生产的信号【64】。
因此,微生物在高粘度环境中的行为似乎象生物膜,而在低粘度环境中表现更象游离微生物。这表明代谢活动减少并不与耐受直接相关,而生物膜表型能在没有与表面附着的情况下表达。这些发现可能会对伤口治疗产生深远影响。一个高度渗出的伤口通常有感染和高度发炎。炎症和渗液的存在表明伤口有良好的来自临近的血供,而全身用抗生素很少会对慢性伤口中的细菌产生有效作用。对此我们常会归咎于血供不佳,但其可能更多与存在具有生物膜表型的微生物有关。在中至高度渗出的伤口,水分蒸发会导致残留液体粘度增加(因蛋白质浓度增加)。在此环境中的微生物或许能够表现出生物膜特征,包括抗生素敏感性降低,使其变得难以控制。这或许也解释了在囊性纤维化病人肺部感染控制中的问题。
慢性伤口中的生物膜
在慢性伤口中我们能轻易发现细菌生物膜。伤口中存在生物膜的早期证据来源于实验动物慢性伤口,进而在临床伤口中得以证实【68,69】。慢性伤口细菌集落有显著的异质性,致病菌战胜共生菌成为主导微生物菌落【35,70】。
不同伤口间细菌类型和数量有显著差别【2,49】。有研究显示每个伤口中存在17种细菌(需氧和厌氧)【49】。另一研究发现伤口中存在的典型微生物有12-20种,而常见的有60多种【2】。很多研究显示完整皮肤的微生物群落越丰富,对感染扩散或机会菌和致病菌的积聚的保护越大【49,71,72】。然而,某些致病菌(如金葡菌和绿脓杆菌)的引入,能替代无害的共生菌,导致感染的发生。这表明给予慢性伤口益生菌治疗或许可以将微生物生态扭转为健康状态【35,70,73】。
氧气受限、生物膜深部,都会促进慢性伤口中厌氧菌的增殖【54,70】。因此,与其关注于伤口中的细菌负荷,考虑存在的种类和其与伤口的相互作用也很重要;包括确定伤口中的菌种是否相互促进或竞争【2】。经常能观察到不同菌种间能相互产生协同效应,产生慢性生物膜伤口感染。这些被称为“功能对等病原共同体”(functional equivalent pathogroups),可能有数百个之多【47】。
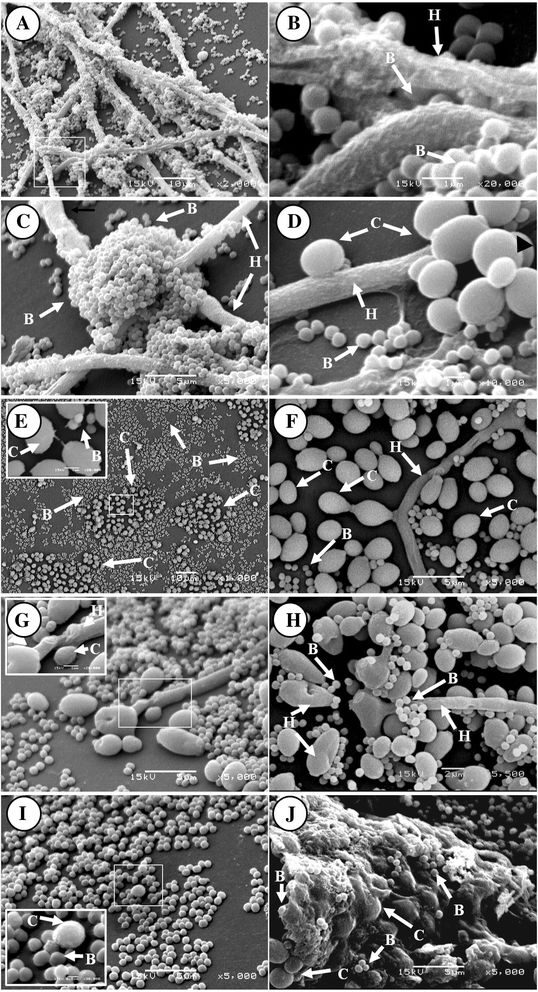
除了含有多种不同种类的微生物,生物膜中包含了处于不同生长周期阶段的细胞。生物膜深部存在生长率降低的微生物,可以保护细菌免受影响,包括pH变化、化学物质浓度、渗透压、以及需要积极的细菌胜正才能发挥作用的化学物质【48】。此外,生物膜含有很多浓度梯度,创造出一个对抗生素和抗菌剂有负面作用的微环境,而在某些案例中,则能促进特定种类微生物的生长。这些微环境可能包括需氧和厌氧微环境【48】。尽管一些作者认为生物膜的大部分细胞似乎能被抗生素杀死,在治疗后,慢性伤口中的生物膜又快速再生。这表明在生物膜中存在持留细胞【75-77】。据估计,持留细胞占到生物膜的0.1%-10%,并且也存在于游离菌培养中【78】。这些细胞被认为发生了表型改变而能够耐受抗生素,例如变得代谢不活跃或休眠和/或关闭了抗生素靶点【48】。
抗菌治疗效果不佳也可能与抗菌剂穿透生物膜能力的下降或不能有关。胞外聚合物带有净负电荷,能够隔离带有正电的复合物质和/或击退带有负电荷的复合物质,防止其与生物膜中微生物的接触。一些微生物也能释放可以隔离抗生素的分子【48】。总体来说,这使得治疗慢性、生物膜相关的感染比急性、游离菌感染更加困难。
不幸的是,当前存在的很多治疗是设计用于治疗急性感染的,而急性感染通常快速出现、病程较短。游离菌通常对抗生素敏感,也能被健康的免疫系统消灭【79】。相反,慢性伤口与急性伤口相比,通常表现得很顽固和有过多的炎症反应,而且对抗生素不敏感【40】。
成熟的生物膜能在10个小时内在慢性伤口中形成,而且只要伤口开放,其就能永远存在【80,81】。此外,一项临床研究发现尽管外科清创能有效清除慢性伤口床的生物膜,而生物膜在初次清创后2天又重新形成,清创后3天则能在成熟的生物膜中发现大量的细菌【82】。这表明清创后存在一个机会窗口,期间努力想要植根伤口床的游离细菌对治疗敏感,有效治疗可防止生物膜的再次形成。
借助显微手段,生物膜可以在多达60%的慢性伤口中发现,但仅有6%的急性伤口可见【83】。研究也将慢性伤口中可能存在的生物膜(肉眼判断)与急性伤口感染、慢性骨骼感染、湿度失衡和潜在的动脉循环障碍联系起来【84】。慢性生物膜感染持续存在,难以根除。他们对抗生素反应不彻底,根据最低抑制浓度(minimum inhibitory concentration, MIC)检测结果进行处方开具后,生物膜常在抗生素治疗疗程结束后马上重现。
即便如此,在慢性伤口中形成的生物膜与其他类型感染中观察到的不同。事实上,在很多慢性伤口中,真正生物膜的存在很难证实。然而,伤口环境中微集落的形成通常比较明显。鉴于一些种类的细菌如绿脓杆菌已经被发现在微集落阶段已经展现出AIs水平升高的效应,而一些AIs具有直接影响人体细胞的能力,这些微集落的存在或许足以促进伤口慢性化的形成。例如,如果微集落大到足以阻止被吞噬细胞吞噬,失败的吞噬作用可能会造成一些吞噬细胞的脱颗粒。这会导致过度的免疫反应,改变伤口中很多因素的平衡,例如,有推论认为基质金属蛋白酶能抑制正常的伤口闭合。当此类免疫反应减弱,伤口便可以正常/更快愈合【85,86】。
识别药物抵抗/耐受、敏感性,和治疗
尽管建议使用标准敏感性实验【87】,标准MIC敏感检测的效用受到了质疑【88】。MICs检测抗生素对游离细菌的作用,是治疗急性感染时的重要参考。然而,将MICs用于涉及生物膜的慢性伤口和器械相关感染的治疗中通常无效【43】。
有研究检查了从囊性纤维化病例中分离出的绿脓杆菌生物膜样本的敏感性,将结果与标准的MIC结果进行了比较。结果发现在通气阻塞与生物膜抗菌耐受之间存在关联。根据敏感性实验结果给予患者抗生素治疗后,患者痰中细菌密度和住院时间均显著减少【89】。研究人员也证实临床结果的显著改善与基于MIC检查的抗生素治疗相关。
体外抗生素抗(绿脓杆菌)生物膜活性的证据,和两种方法(生物膜vs 标准MIC)确定的不同敏感类型支持根据临床微生物实验室调整生物膜敏感性检查方法的可行性【90】。这给我们带来新的方法来选择针对慢性感染的更有效的(与当前所用方法相比)抗生素组合【90】。有研究针对烧伤伤口微生物检测了一种体外模型,结论认为这种检测实用、可复制、对选择治疗烧伤伤口生物膜的抗生素有用【91】。
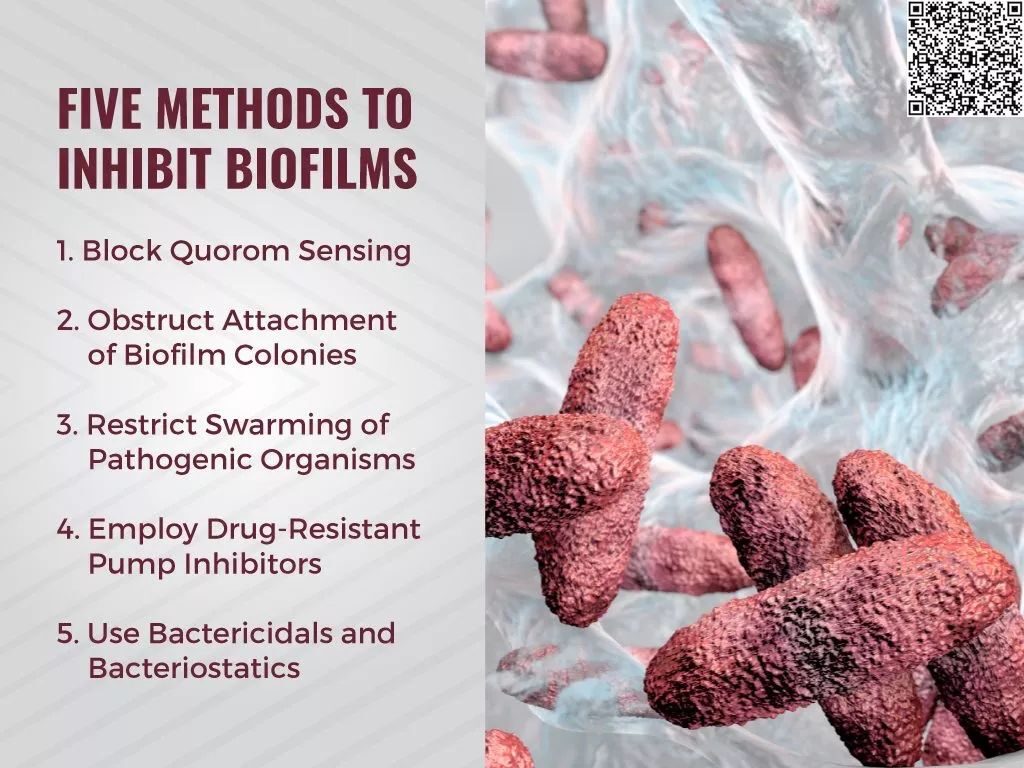
抑制生物膜的5种方法:阻断群体效应、阻止微生物附着、限制致病菌积聚、使用耐药泵抑制剂、抗菌剂
对于新治疗策略的研究
越来越多的细菌在基因水平对抗生素耐药。此外,即便细菌没有在基因层面对抗生素耐药,也可能通过其生长模式来耐受抗生素。泛耐药菌的问题和需要新的方法来解决该问题已经变得越来越急迫【95】。尽管如此,鲜有制药公司在探索新的抗生素治疗【96】。部分原因是因为发现新药物的难度和花费。这一困难,加之抗生素治疗疗程通常较短,使该领域没有足够的财务吸引力。因此,人们在考虑可以降低细菌毒性的方法,此类药物不会真正杀死细菌,而是干扰细菌产生毒性因素的能力,例如形成生物膜过程中产生的因素,正是这些因素促进了耐药的发生。这些方法的主要吸引力在于其对于细菌社群没有高度选择性,因此降低了新的抗生素耐药机制的出现【97】。
不幸的是,近期主要关于绿脓杆菌的研究为我们提供了大量的现实认识。在研究对抑制群体效应复合物耐药发生的实验中,细菌似乎能够产生对这些分子的抵抗【98】。因此,维持细菌负荷控制在某种水平的策略和抑制过度的免疫反应对于使宿主解决感染是必要的。当前,对于慢性伤口,具体策略涉及抗菌敷料和积极清创技术的联合使用。
很多目前在研的抗生物膜治疗方法都基于以下事实:随着资源变得匮乏和废物或其他毒素积聚,生物膜最终会解体,存活细胞离开生物膜、向周围播散【99-101】。生物膜解体常涉及酶破坏基质构成,因而解放生物膜相关细胞;因此,酶治疗或许是根除生物膜的一种方法【99,102】。同时,人们研制出可以攻击生物膜细胞和制造基质降解酶的重组噬菌体【99,103】。此外,鉴于生物膜形成需要细胞间的信号传导,一些研究人员认为能干扰信号传导路径的小分子可能是根除生物膜的有益方法【99】。一些分子能够自然激活和介导生物膜的解体,其机制包括信号传导、细胞被膜修饰分子、抗基质分子、促细胞死亡分子。
原文作者:Amin Omar
原文出处:Microorganisms 2017, 5(1),9;
https://doi.org/10.3390/microorganisms5010009
内容转载自@慢伤前沿公众号!
