伤口愈合是一个很复杂的生理过程,一般可分为相互重叠的3/4个阶段,但每个阶段都有特定的生理过程,一直想对伤口愈合过程进行一个简短的描述,以供大家参考,今日在文字基础上配以形象的图片,希望能帮助大家理解伤口愈合的正常过程。
正常伤口愈合过程
对伤口愈合病理生理机制的深入理解显著提高了伤口的临床诊疗水平。伤口愈合是多细胞生物中最复杂的过程之一,涉及多种细胞内和之间的众多信号传递。以伤口修复为主要目标的生物过程中有物理、化学和细胞因子的参与。
皮肤伤口的愈合机制可分为修复(Repair)或再生(Regeneration),两种类型的愈合有着清晰和重要的区别。伤口修复中的新生组织的特征和特性远不及原本的组织,而伤口再生的目标是用与原本组织完全一样的组织来重建受损组织,以恢复受损组织的形态以及功能。
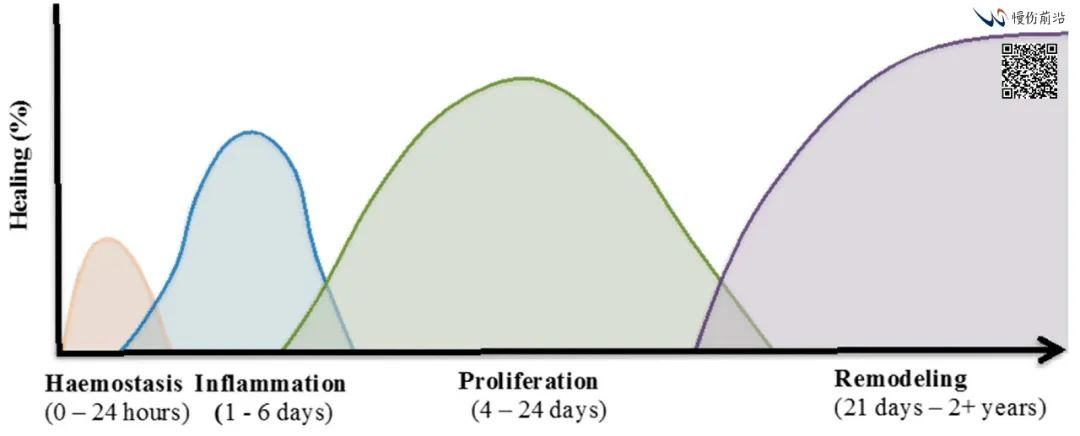
伤口愈合的过程通常可分为3/4个相互重叠的阶段:止血(Haemostasis)/炎症期(Inflammation)、细胞增殖(Proliferation)和重构(Remodeling),受到多种细胞、细胞因子和生长因子的调控。
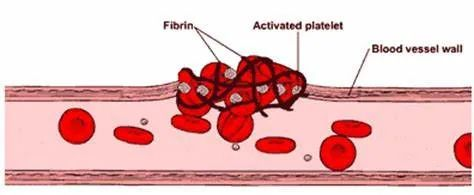
皮肤受损后,血小板被刺激而在受损部位聚集,同时形成纤维蛋白凝块,促进止血和将几种不同的细胞吸引至伤口。生长因子和细胞因子、以及其他凝血连锁反应所需的凝血因子的分泌也发生于伤口愈合的第一阶段。凝血和血小板脱粒激活了炎症反应(期)。该期的主要特点是五羟色胺、组胺和生物活性因子的释放,导致毛细血管通透性增加,进而吸引炎症细胞进入伤口区域,包括中性粒细胞、白细胞和巨噬细胞。伤口部位最高浓度的中性粒细胞出现于受伤后1-2天,在巨噬细胞的帮助下对于防止细菌感染发挥了主要作用,他们还会激活角质细胞、成纤维细胞和免疫细胞。
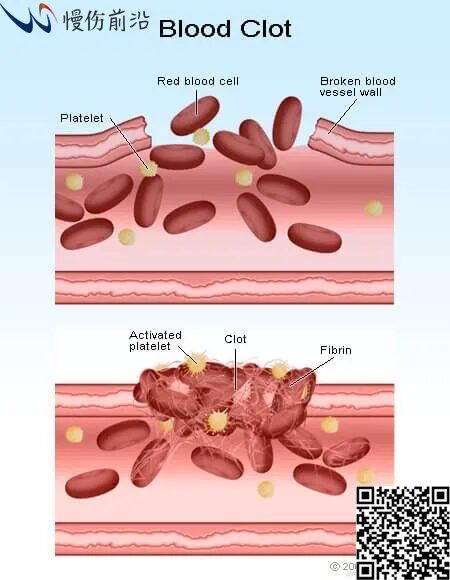
血小板激活和凝血栓子
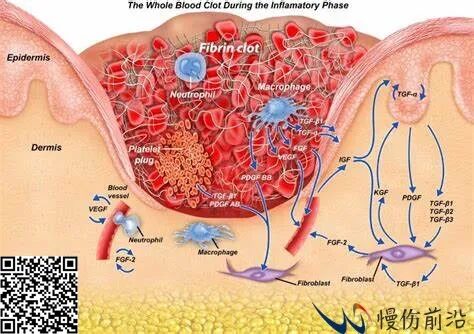
炎症期
伤口愈合炎症期的最后,巨噬细胞会发展出抗炎、促纤维化表型,分泌TGF-β、白细胞介素、和肿瘤坏死因子。这些生长因子会刺激增殖期的开始,即出现纤维组织增生、基质沉淀、血管生成、再上皮化。增殖期内会从周围完好组织招募成纤维细胞,VEGF刺激内皮细胞的迁移而促进新血管的生成。激活的成纤维细胞负责分泌细胞外基质,其中含有高水平的不成熟的III型胶原蛋白,这与在正常皮肤和成熟疤痕中所能见到的I型胶原蛋白完全不同。伤口中最高浓度的胶原蛋白出现于最初受伤大约三周后。同时,受伤3-5天后开始,纤维蛋白栓子开始被肉芽组织替代,且伤口开始收缩。最终,进入伤口愈合的最后一个阶段,即被称为重构或成熟期(Remodeling或Maturation),此时由于迁移和细胞凋亡而导致伤口区域内细胞成分的减少。重构是一个动态过程,期间胶原蛋白与胶原蛋白及其他蛋白质分子间可形成紧密的交联,增加成熟疤痕的抗张强度,最高可至未受伤皮肤的80%。此外,随着不成熟的III型胶原蛋白转变为成熟的I型胶原蛋白,III型和I型胶原蛋白的比率下降,这一过程可持续达2年。
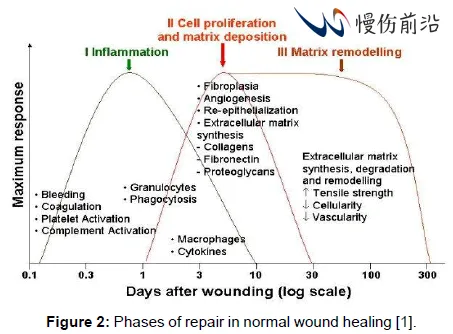
正常伤口愈合阶段和各期的特定生物过程
有多种生长因子、细胞因子、整合素、角蛋白、基质金属蛋白酶、趋化因子、和细胞外大分子参与和调节复杂的伤口愈合过程。下表所列为伤口愈合过程中涉及的生长因子。
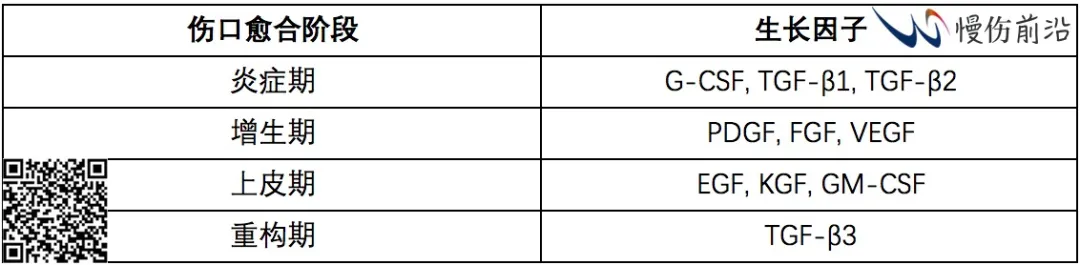
病理性伤口愈合
有一些病理生理和代谢疾病会改变正常的伤口愈合过程,造成伤口愈合延迟,导致慢性伤口的产生,持续超过6周以上而不愈合。
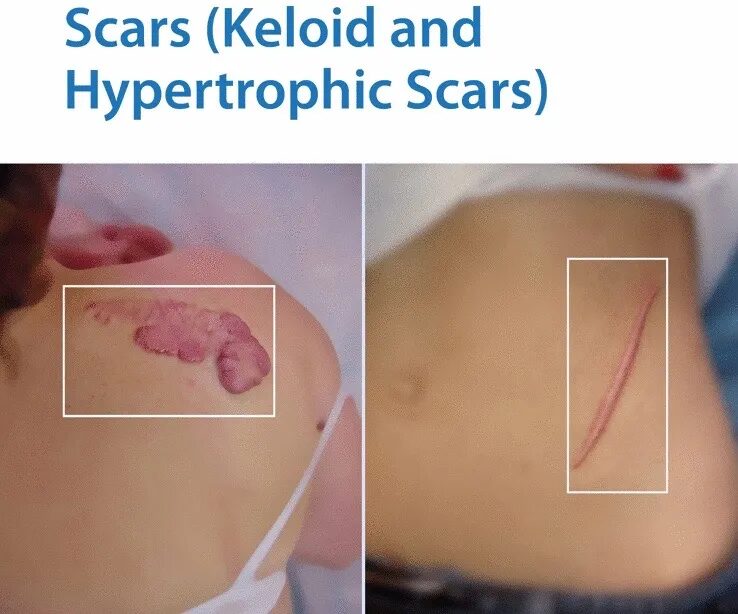
疤痕疙瘩和增生性疤痕
无论病理性伤口愈合的起源是什么,其会导致纤维增生性疾病,基本可分为两种类型,即:增生性疤痕和疤痕疙瘩,均代表过度愈合反应(Over-healing),而溃疡或慢性伤口代表了相对的另一端,即愈合不良反应(Under-healing)。增生性疤痕与长时间的炎症期有关;而在溃疡中,可见蛋白水解酶活性增加和细胞增殖和迁移受损。
内容转载自@慢伤前沿公众号!
